Как растворялся спирт
аффтар: SPF
Везде по тексту спирт – это этанол, С2Н5ОН.
Немного истории. Основы.
Дмитрий Иванович Менделеев сидел за столом и, как обычно в минуты тяжких размышлений, разлиновывал лист бумаги на квадратики, надеясь, что никто не помешает попозже раскрасить их и нарисовать внутри прикольные циферки и буковки, отвлекающие от тяжкой жизни заведующего кафедрой неорганической химии Петербургского технологического института. Шел далекий 1880 год.
Дмитрий Иванович вспоминал диссертацию, защищенную в 1865 году, и приведшую к перманентному абстинентному синдрому - плата за бесчисленное количество рискованных экспериментов. А хуле, тема "О соединениях спирта с водой" это не каждому по силам. Тут и здоровье нужно, и готовность к самопожертвованию.
Не все гладко получилось в этом труде, оставалось чувство неудовлетворенности и интуитивное знание, что решение близко, буквально на дне пробирки. Но как же нелегко его поймать! Пятнадцать лет в тяжких трудах и работах со спиртовыми растворами. Помогали соратники, мастера своего дела В.Е. Павлов, В.Е. Тищенко, И.Ф. Шредер, С.П. Вуколов, прошедшие не один курс реабилитации. Все они сильно сдали за последние годы, начали нести на семинарах откровенную хуйню, а также демонстрировать непропорциональные реакции на объективные трудности с поставками спирта в лабораторию.
Да и сам, как-то, в пылу научных баталий, ухитрился обменять жену - падчерицу автора «Конька-Горбунка», на подвернувшуюся пелотку из Урюпинска, а одну из дочерей подарил незнакомцу, пиздато прочитавшему стихотворение «Африканец в белом чепчике из роз», или типа того, название вспомнить никак не удавалось, как и имя дочери.
Вспомнил Дмитрий Иванович и покойного отца, как незадолго до скоропостижной смерти, случившейся 33 года назад от приема во внутрь неизвестной медицине 19-го века жидкости с характерным запахом, тот гладил слегка дрожащей рукой кучерявую голову 13-летнего Димки и с хрипотцой в голосе говорил: «С умом пей сына, думай, что в глотку льешь, а то, как батька, ослепнешь и с работы попрут!»
«Химия, химия, вся залупа синяя», крутился в голове ученого незамысловатый мотив.
«Бля, а ведь правда, что-то такое мы вчера со Шредером выпили неподумавши!» - вскинулся Дмитрий Иванович, и даже отодвинул бумажку с квадратиками.
«Раствор спирта в воде, как всегда? Нихуя, по-пристальнее присмотреться надо! И Шредер тоже пусть покумекает».
Как позже Менделеев написал в своем классическом труде «Исследование водных растворов по удельному весу»: «Я не мог утерпеть, ... были составлены по удельному весу возможно точно два раствора спирта ... в тонкостенных пробирных цилиндрах ... спустя немного времени....». И понеслось! Прорыв состоялся!
К сожалению, через сравнительно короткое время, Менделеевым и соратниками был создан превосходящий самые смелые предсказания современной (им) науки раствор спирта, клюквенного сока и глюкозы, оказывающий фантастическое действие на юных аспиранток кафедры.
Дмитрий Иванович с головой нырнул в раскрытие этой темы, тратил все доступное время, была забыта даже привычка линовать бумагу. Чрезмерно углубившись в узкие вопросы, Дмитрий Иванович прогнозируемо вступил в конфликт с министром просвещения, и в 1890 году покинул Петербургский университет.
Волшебный напиток под названием «Менделеевка» с тех пор активно применяется в Университетах и академических Институтах мира, а мы попытаемся понять, что же Дмитрий Иванович разглядел в, казалось бы, безобидном растворе спирта.
Что мы пьем. Уже серьезней.
Менделеев присмотрелся к диаграмме состояния «вода – спирт». Проанализировав результаты измерений удельного веса различных растворов спирта в воде (не только свои, но и многих других ученых), Дмитрий Иванович пришел к выводу, что зависимость удельного веса от концентрации не монотонная, а описывается четырьмя параболами.
Параболы хуй разглядишь, а вот если изобразить производную удельного веса по весовой концентрации спирта, то будут видны 4 перелома. Позднее такой подход лег в основу теории гидратов – поиск особых точек на диаграммах «концентрация - свойство».
Объяснение было найдено быстро. В системе «вода – спирт» существует три устойчивых химических соединения (устойчивость Менделеев доказал в рамках тех же работ). А именно: гидраты спирт*12Н2О, спирт*3Н2О и 3*спирт*Н2О. Ну, еще, конечно, вода и спирт в случае предельных концентраций. Отвлекусь: а вот если нуля не существует, то и воды без спирта не бывает, что ли? Парадокс ...
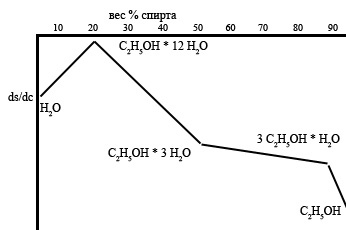
Далее, из графика можно увидеть следующее:
Если принять, что удельный вес чистого спирта равен 0.8, то 40% об. соответствуют 32% весовой концентрации, и водка находится в области смеси 3-х и 12-и водных гидратов.
Китайская водка 56% об. - это практически чистый тригидрат, а сливовица 70% об. содержит еще и 3*спирт*Н2О.
Такая непростая химическая система должна находиться в термодинамическом равновесии (а то начнет распадаться на компоненты, потеряет вкусовые качества и ну его нахуй). А вот удастся ли системе достичь равновесия, или застрять в неравновесном, а то и гляди метастабильном (чур меня!) состоянии, зависит, оказывается, от способа (и скорости) ее приготовления.
Не лейте тупо спирт в воду! Не тупите и не лейте воду в спирт! Будет у вас не водка (смесь 3-х и 12-и водных гидратов), а теплая жидкость с характерным запахом и вкусом спирта. Заебетесь всякие там орешки и травки добавлять. А что же делать??? Во первых, не ссать!
Еще немного науки. Как работают профессионалы.
Проснувшись темным зимним утром, ученый долго тряс головой, пил холодные одно, двух и даже трех – компонентные растворы, и с тупым недоумением всматривался в накорябанную на столе кем-то из вчерашних коллег формулу:
спирт + вода -- водка + тепло
Раздражала стрелка, указывающая налево. «Это ж как, что за пиздец? Водка распадается? И тепло выделяется? А, может, поглощается? Это надо прекращать! Западло теплую распавшуюся водку пить! Ой бля, зачем я об этом!!!!».
Уже через пару секунд, ритмично чередуя сокращения сфинктера, пищевода и мозга, ученый читал свою любимую книжку - «Основы химии» Менделеева. В этот раз она открылась на странице с фотографией братской могилы Ле Шателье – Брауна с надписью «Сместителям равновесия. Химические реакции вас не забудут». «Да, принципиальные люди были», вздохнул при очередном расслаблении мозга ученый. «За то и пострадали», - добавил, освободив пищевод.
Сокращения резко прекратились. Вот он, момент истины! Как можно было забыть такое!
Принцип Ле Шателье – Брауна! Чтобы сместить равновесие реакции, идущей с выделением тепла (экзотермической) направо (в сторону продукта, то есть, водки), надо охлаждать реактор.
Сомнения не заставили себя ждать. И что, будем разводить спирт в холодильнике? Да он же тесный, и обмерз так, что сосиску не просунешь! Полный льда, ебать его так. Уплотнители прохудились, что ли? Да и хуй с ними, не до того.
Предварительно охлаждать спирт? Нечеловеческое терпение на это нужно. И холодильник разморозить сперва. Да и вообще, полный холодильник спирта у дееспособного хозяина? Интуиция подсказывает, что это или хуйня, или пропаганда.
Так. Нужны спирт, вода и холод. И все сразу. И быстро.
Ученый погрустнел, отложил книжку, подошел к окну и задумался.
«Блин, когда уже отремонтируют теплотрассу? Сколько народу полегло! Дома в фуфайке круглые сутки ходить заебало. И по катку блядскому во дворе ходить страшно, того и гляди ноги переломаешь. Жопа, короче».
«Лед, лед, лед! Поймете вы однажды - Этот лед придуман для отважных» неожиданно заорал соседский телевизор. Ебать-колотить, только этой хуеты не хватало!!! Ученый икнул и потянулся к лежащему у батареи отопления разводному ключу.
Стоп! Вот оно!!!
Вода и холод прекрасно совмещаются во льду. Решено – наливаем спирт в ледяную крошку. Крошку? Почему? Ну, официальное объяснение – потому, что площадь поверхности больше, а если честно – лед ведь с холодильника отдирать будем, тут уж не до эстетики.
Насыпаем лед в емкость и приливаем спирт. У профессионала свободные емкости и спирт есть всегда. И глазомер не подводит ни при каких обстоятельствах.
При смешивании льда (0 градусов Цельсия) и спирта (10 – 15 градусов Цельсия, комнатная температура, чтоб сдох Чубайс), лед начинает плавиться, забирая тепло (а надо его дохуя) от смеси. Температура смеси резко падает (существенно ниже нуля), емкость покрывается инеем. Это не мешает реакции, жидкости не замерзают: температура замерзания спирта -50, 50% раствора -36, а 35% раствора -25 градусов Цельсия.
Наблюдаем формирование трех слоев: нижний – водка, средний – лед, верхний – спирт. При этом толщина нижнего слоя увеличивается за счет уменьшения толщины верхних слоев. Что радует ни па децки!
Температура остается постоянной, иней не тает.
Примечание - распределение слоев по высоте соответствует плотностям компонент.
Через некоторое время весь спирт прореагирует со льдом, температура повысится, иней растает, а на поверхности будут дотаивать последние кусочки льда. Свершилось! Ну, будем здоровы!
На этом можно бы и остановиться, но честный ученый не останавливается на достигнутом, идет до конца, чего бы этого ни стоило, чтобы предостеречь нетерпеливых (захотят подлить воды, чтоб поскорее), или тормознутых (будут дооолллггго крошить лед, и он растает) коллег от страшных ошибок, грозящих гибелью современной цивилизации.
Не сметь добавлять воду! Почему, спросит читатель? «А ниипет», ответил бы технолог, «иди в хуй», сказал бы инженер. Но ученый, успешно проведший эксперимент и, как положено, проверивший его результаты на себе, готов к диалогу.
Завершение.
Ученый Уиллард Гиббс был задумчив и слаб здоровьем. В юности он сколотил семейный ансамбль, в состав которого входили его сестры в количестве двух штук и он. Ансамбль так и назвали – ансамбль Гиббса. Из-за репертуара, в основном классического, и крайне малого количества музыкантов, репортеры окрестили его обидным прозвищем «микроканонический». Но не о том речь, оставим эту тему историкам музыки.
Слишком озабоченное практическими вопросами американское общество не замечало ученого. Впрочем, заслуженно. Так и не смог он продвинуться далее 4-х действий арифметики (впрочем, в вычитании и делении по очевидным причинам Гиббс был совсем слаб).
Занимался он, в основном, смешиванием и выпариванием жидкостей, а также выпусканием газов, обычно после употребления свежеприготовленных растворов.
Через 5-6 лет таких занятий Гиббс зафиксировался на правозащитной деятельности, ввел понятие свободной энергии, и занялся практическими попытками ее освобождения, воруя газовые баллоны из соседских домов. В ходе одной из таких операций в апреле 1903 года он и погиб неподалеку от собственного дома.
Однако, его учебники и тетради с нелепыми пометками стали достоянием научной общественности, которая и обнаружила в них знаменитое правило фаз Гиббса, выведенное в попытках рассчитать возврат налогов с учетом цен на газ в 1889 году:
С = К – Ф + 1,
где С – число термодинамических степеней свободы системы, К – количество независимых компонентов системы, Ф – число термодинамических фаз, из которых состоит система.
Как же это применить к нашей работе? Растворению спирта в воде?
Мы хотим, чтобы весь лед прореагировал со спиртом. И мы хотим, чтобы эта реакция шла при низкой температуре, с целью смещения ее равновесия в сторону синтеза водки, а не ее распада на воду и спирт. На это нужно время. И все это время система должна оставаться при постоянной низкой температуре, не изменяясь. Нам нужна нонвариантная система – система с нулевым числом термодинамических степеней свободы. То есть,
К – Ф + 1 = 0
Далее, К = 2 (вода и спирт), значит, Ф должно быть = 3. Что и имеем в случае смеси со льдом:
три фазы – спирт, лед и водка (раствор).
Если добавить воду, то количество фаз уменьшается до двух (раствор и лед), система приобретает степень свободы и – прощай-прости высокий выход полезного и качественного продукта.
Пейте с умом, иначе будет мучительно больно за бесцельно проведенные годы!
Для самостоятельной работы в каментах:
1. Рассчитать веса спирта и льда для изготовления русской водки в количестве, необходимом для приема 10-и гостей.
2. Как нам помогает Природа, грамотно распределившая плотности спирта, льда и водки? Продвинутый уровень – почему так получилось?
3. Приведите термодинамическое объяснение процессу извлечения спирта из клея БФ-6.
оригинал и каменты http://www.udaff.com/archive/nauka/90303.html |